Hui tinc per a vosaltres un exercicis de la llei de la conservació de la massa.
Física y química
jueves, 25 de febrero de 2016
miércoles, 24 de febrero de 2016
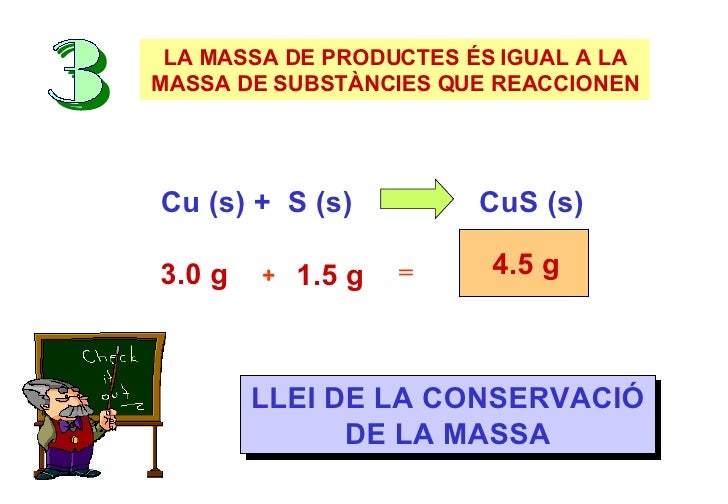
Llei de conservació de la massa
Hui vaig a
parlar-vos sobre la llei de la conservación de la massa i a on aplicar-la.
La llei de
la conservació es basa en que :
La massa
dels productes d'una reacció química és igual a la massa dels reactius de la
reacció.
Exemple:
NaHCO3 + CH3 –CO2H
---> CH3–CO2Na + CO2 + H2O
84 + 60 = 82 + 44 + 18
Balanç molar
1 mol de + 1 mol d’ = 1
mol d’ + 1 mol + 1
mol
Bicrbonat àcid acètic aceitat sòdic de diòxid d’aigua
de
carboni
http://www.slideshare.net/tic.formacio/la-reacci-qumica-239039
jueves, 4 de febrero de 2016
Exercicis de Reaccions químiques
Hui tenim un exercicis sobre ler reaccions químiques, teniu que ajurtar-les, a la millor hi han ja algunes ajustades.
miércoles, 3 de febrero de 2016
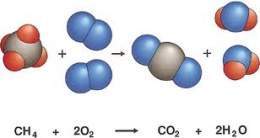
La reacció química.
Avui vaig a
parlar-vos sobre la reacció química.
La reacció química és tot procés termodinàmic en el qual una o més substàncies es transformen, canviant la seua estructura molecular i els seus enllaços, en altres substàncies crides productes.
La reacció química és tot procés termodinàmic en el qual una o més substàncies es transformen, canviant la seua estructura molecular i els seus enllaços, en altres substàncies crides productes.
-Reactius à Productes
-Canvi
químic à Canvi en la composició.
-S’ha de
cumplir la Llei de conservació de la massa de la qual parlarem un altre dia.
Exemple:
http://www.ecured.cu/Reacci%C3%B3n_qu%C3%ADmica
Exemple:
CaCO3 ->
CaO + CO2

http://www.ecured.cu/Reacci%C3%B3n_qu%C3%ADmica
jueves, 28 de enero de 2016
martes, 26 de enero de 2016
El mol (II)
Hui
vaig a continuar parlant-vos sobre el mol y també us diré la seua fòrmula per a
poder calcular-lo.
El
mol és una massa atómica/molecular expresada en grams.
és 6,02·1023 partícules. (àtoms, molècules, ions, etc…)
és 22,4 l de qualsevol fluid en condicions normals.
La
seua fòrmula es:
Quantitat de “x” (g)
Nº de mols de “x” = ______________________________
Massa atómica/ molecular de “x” (g)
Exemple: massa atòmica
1·32
= 32
4·16 = 64
Massa
atómica = 2+32+64= 98
2· 6.02·1023 àtoms d’Hidrogen
1· 6.02·1023 àtoms de Sofre
4· 6.02·1023 àtoms d’Oxigen
martes, 19 de enero de 2016
El mol (I)
Hui
vaig a parlar-vos, com ja vaig dir l’anterior dia, sobre el mol.
El
mol en l’unitat básica de la quantitat de substància segon el sistema
internacional d’unitats.
1
mol de “qualsevol cosa” = al nº de Avogadro = 6,02·1023 partícules=
=602000000000000000000000.
1
mol de “x”= massa de “x” expresada en grams.
1 mol d'àtoms d'Hidrogen es 1g.

https://blogmundoquimica.wordpress.com/2014/05/26/mol-numero-de-avogadro/
1 mol d'àtoms d'Hidrogen es 1g.
https://blogmundoquimica.wordpress.com/2014/05/26/mol-numero-de-avogadro/
Suscribirse a:
Comentarios (Atom)


