Hui tinc per a vosaltres un exercicis de la llei de la conservació de la massa.
jueves, 25 de febrero de 2016
miércoles, 24 de febrero de 2016
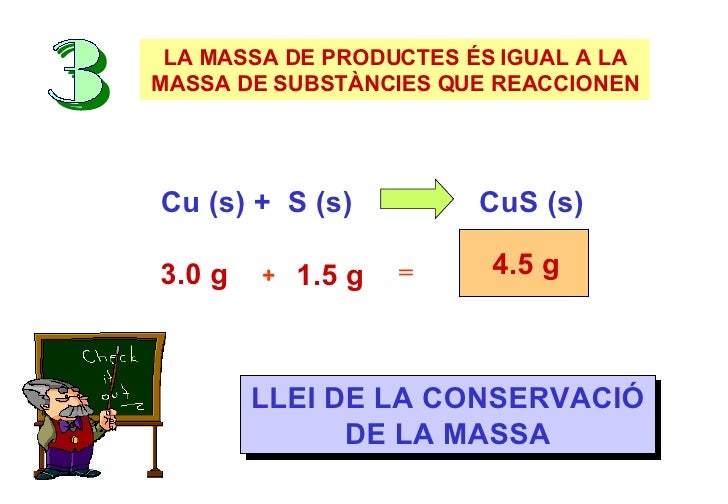
Llei de conservació de la massa
Hui vaig a
parlar-vos sobre la llei de la conservación de la massa i a on aplicar-la.
La llei de
la conservació es basa en que :
La massa
dels productes d'una reacció química és igual a la massa dels reactius de la
reacció.
Exemple:
NaHCO3 + CH3 –CO2H
---> CH3–CO2Na + CO2 + H2O
84 + 60 = 82 + 44 + 18
Balanç molar
1 mol de + 1 mol d’ = 1
mol d’ + 1 mol + 1
mol
Bicrbonat àcid acètic aceitat sòdic de diòxid d’aigua
de
carboni
http://www.slideshare.net/tic.formacio/la-reacci-qumica-239039
jueves, 4 de febrero de 2016
Exercicis de Reaccions químiques
Hui tenim un exercicis sobre ler reaccions químiques, teniu que ajurtar-les, a la millor hi han ja algunes ajustades.
miércoles, 3 de febrero de 2016
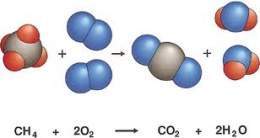
La reacció química.
Avui vaig a
parlar-vos sobre la reacció química.
La reacció química és tot procés termodinàmic en el qual una o més substàncies es transformen, canviant la seua estructura molecular i els seus enllaços, en altres substàncies crides productes.
La reacció química és tot procés termodinàmic en el qual una o més substàncies es transformen, canviant la seua estructura molecular i els seus enllaços, en altres substàncies crides productes.
-Reactius à Productes
-Canvi
químic à Canvi en la composició.
-S’ha de
cumplir la Llei de conservació de la massa de la qual parlarem un altre dia.
Exemple:
http://www.ecured.cu/Reacci%C3%B3n_qu%C3%ADmica
Exemple:
CaCO3 ->
CaO + CO2

http://www.ecured.cu/Reacci%C3%B3n_qu%C3%ADmica
jueves, 28 de enero de 2016
martes, 26 de enero de 2016
El mol (II)
Hui
vaig a continuar parlant-vos sobre el mol y també us diré la seua fòrmula per a
poder calcular-lo.
El
mol és una massa atómica/molecular expresada en grams.
és 6,02·1023 partícules. (àtoms, molècules, ions, etc…)
és 22,4 l de qualsevol fluid en condicions normals.
La
seua fòrmula es:
Quantitat de “x” (g)
Nº de mols de “x” = ______________________________
Massa atómica/ molecular de “x” (g)
Exemple: massa atòmica
1·32
= 32
4·16 = 64
Massa
atómica = 2+32+64= 98
2· 6.02·1023 àtoms d’Hidrogen
1· 6.02·1023 àtoms de Sofre
4· 6.02·1023 àtoms d’Oxigen
martes, 19 de enero de 2016
El mol (I)
Hui
vaig a parlar-vos, com ja vaig dir l’anterior dia, sobre el mol.
El
mol en l’unitat básica de la quantitat de substància segon el sistema
internacional d’unitats.
1
mol de “qualsevol cosa” = al nº de Avogadro = 6,02·1023 partícules=
=602000000000000000000000.
1
mol de “x”= massa de “x” expresada en grams.
1 mol d'àtoms d'Hidrogen es 1g.

https://blogmundoquimica.wordpress.com/2014/05/26/mol-numero-de-avogadro/
1 mol d'àtoms d'Hidrogen es 1g.
https://blogmundoquimica.wordpress.com/2014/05/26/mol-numero-de-avogadro/
martes, 12 de enero de 2016
Sistema d'unitats
Hui vaig a
començar el blog ensenyant-vos la tabla del sistema d’unitats internacional.
Perquè el pròxim dia vaig a parlar-vos sobre el mol.
Magnitut
|
Nom de l’unitat
SI bàsic
|
Símbol
|
Longitut
|
Metre
|
m
|
Massa
|
Kilogram
|
kg
|
Temps
|
Segon
|
s
|
Intensitat de
corrent elèctic
|
Amperi
|
A
|
Temperatura termodinàmica
|
Kelvin
|
K
|
Quantitat de
substància
|
Mol
|
mol
|
Intensitat lluminosa
|
Candela
|
cd
|
Suscribirse a:
Comentarios (Atom)


